Le cancer n’est plus seulement une maladie qu’on traite avec la chimiothérapie ou la radiothérapie. Depuis une décennie, une révolution silencieuse s’est produite : l’immunothérapie. Deux approches en particulier ont changé la donne pour des milliers de patients : les inhibiteurs de points de contrôle et la thérapie CAR-T. Ces traitements ne visent pas directement les cellules cancéreuses. Ils réveillent le système immunitaire pour qu’il fasse ce qu’il était censé faire depuis le début : détruire les cellules malades.
Comment les inhibiteurs de points de contrôle réinitialisent le système immunitaire
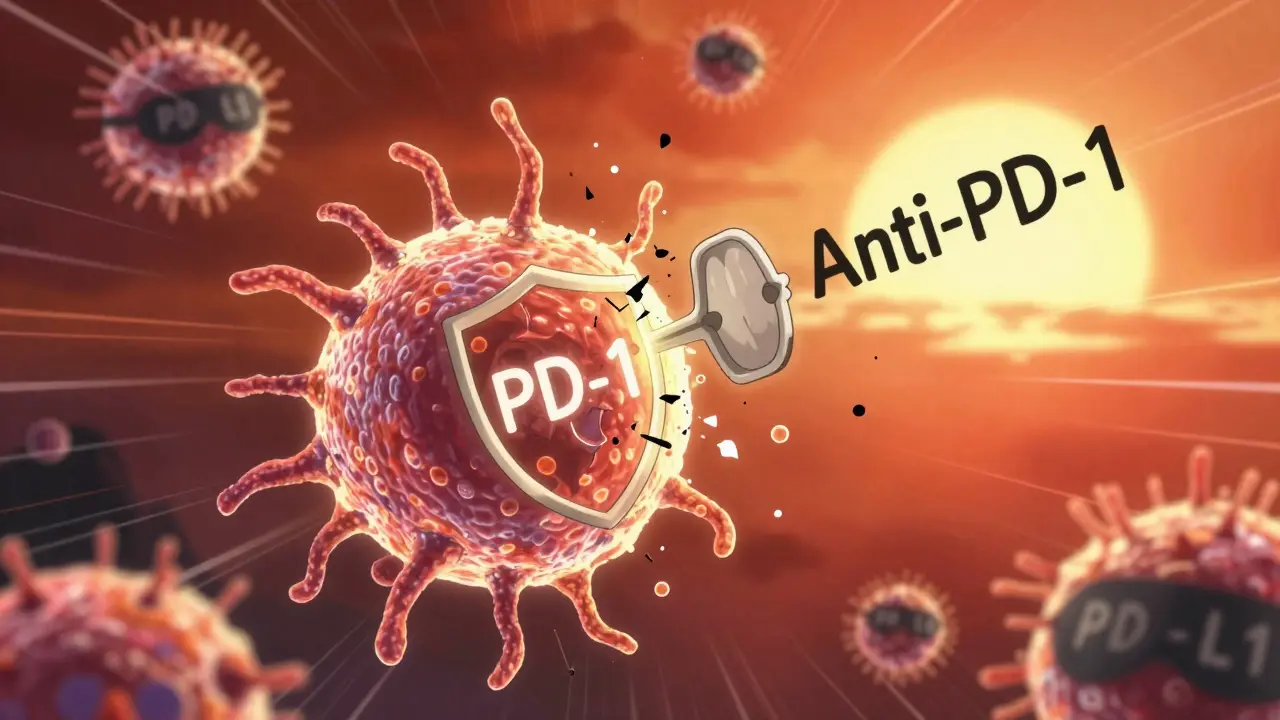
Votre corps possède des freins naturels pour éviter que le système immunitaire ne s’attaque à vos propres tissus. C’est une bonne chose… sauf quand un cancer utilise ces freins pour se cacher. Les cellules cancéreuses expriment souvent des protéines comme PD-L1, qui se lient à PD-1 sur les lymphocytes T, leur disant : « Ne me touchez pas ». C’est comme si le cancer portait un masque d’inoffensivité. Les inhibiteurs de points de contrôle sont des anticorps monoclonaux qui bloquent cette interaction. En prenant le frein, ils permettent aux lymphocytes T de reconnaître et de détruire les cellules cancéreuses. Le premier de ces médicaments, l’ipilimumab (anti-CTLA-4), a été approuvé en 2011 pour le mélanome métastatique. Depuis, des traitements comme le pembrolizumab et le nivolumab (anti-PD-1) sont utilisés pour le cancer du poumon, du rein, du mélanome, et même certains cancers de la tête et du cou. Mais ce n’est pas une solution universelle. Seulement 20 à 40 % des patients répondent à ces traitements. Pourquoi ? Parce que certains tumeurs n’ont pas assez d’« indicateurs » pour que le système immunitaire les voie, ou elles créent un environnement autour d’elles qui étouffe les cellules immunitaires. C’est ce qu’on appelle le microenvironnement tumoral immunosuppresseur.La thérapie CAR-T : transformer les cellules du patient en armes vivantes
La thérapie CAR-T est une approche beaucoup plus personnelle. Elle commence par une simple prise de sang. On extrait les lymphocytes T du patient, puis on les modifie en laboratoire pour qu’ils portent un récepteur artificiel : le CAR (Chimeric Antigen Receptor). Ce récepteur est conçu pour reconnaître une protéine spécifique sur la surface des cellules cancéreuses - comme CD19 dans les leucémies et lymphomes B. Une fois modifiées, ces cellules sont multipliées en grand nombre dans des bioréacteurs - entre 3 et 5 semaines - puis réinjectées dans le patient après un traitement de chimiothérapie pour éliminer les cellules immunitaires existantes et faire de la place. Ces cellules CAR-T deviennent alors des « soldats vivants » capables de circuler dans tout le corps, de repérer les cellules cancéreuses et de les détruire en masse. Les résultats sont spectaculaires dans certains cancers du sang. Pour les enfants et jeunes adultes atteints de leucémie lymphoblastique aiguë récidivante, les taux de rémission complète atteignent 60 à 90 %. Des patients qui n’avaient plus aucune chance voient leur cancer disparaître pendant des années.Les différences fondamentales entre les deux approches
Ces deux traitements sont radicalement différents. Les inhibiteurs de points de contrôle sont des médicaments « tout prêt » : on les administre par perfusion, comme une chimiothérapie. Ils peuvent être utilisés sur des milliers de patients sans personnalisation. La thérapie CAR-T, elle, est un traitement sur mesure. Chaque dose est unique, fabriquée à partir des cellules d’un seul patient. Cela rend le processus long, complexe et coûteux - entre 373 000 et 475 000 $ par traitement. En comparaison, un cycle d’inhibiteur de point de contrôle coûte environ 100 000 $ par an. Les effets secondaires sont aussi différents. Les inhibiteurs de points de contrôle peuvent provoquer des réactions auto-immunes : colite, hépatite, hypothyroïdie, ou une éruption cutanée. Ce sont des effets d’« overdrive » du système immunitaire. La thérapie CAR-T, elle, peut déclencher un ouragan biologique : le syndrome de libération de cytokines (SLC), qui provoque fièvre élevée, chute de la pression artérielle, et parfois des troubles neurologiques (syndrome neurotoxique lié aux effecteurs immunitaires). Jusqu’à 70 % des patients subissent un SLC modéré à sévère.
Combinaison : la prochaine frontière de l’immunothérapie
Les chercheurs ont vite compris que ces deux approches pouvaient se compléter. Les inhibiteurs de points de contrôle réactivent les lymphocytes T existants. La thérapie CAR-T en crée de nouveaux, ciblés. Ensemble, ils pourraient vaincre les tumeurs solides - là où chaque traitement seul échoue. Des études en cours testent des CAR-T « blindés » : des cellules modifiées pour produire elles-mêmes des inhibiteurs de PD-1 directement dans la tumeur. Cela évite les effets toxiques systémiques. Dans les modèles animaux, cette approche a réduit de 37 % les effets secondaires tout en augmentant l’efficacité. Une autre idée : modifier les CAR-T pour qu’elles libèrent de l’IL-12, une cytokine qui attire d’autres cellules immunitaires vers la tumeur. En mars 2024, 47 essais cliniques étaient en cours pour combiner les deux traitements, dont 68 % ciblaient les cancers solides comme le poumon, le sein ou le pancréas. Les premiers résultats sont prometteurs. Mais les défis restent immenses : comment rendre ces traitements efficaces contre des tumeurs qui n’ont pas de cible claire ? Comment éviter que les CAR-T n’attaquent les tissus sains ?Des inégalités criantes dans l’accès aux traitements
Malgré leur potentiel, ces traitements ne sont pas accessibles à tous. Aux États-Unis, les patients assurés privés ont 23 % plus de chances d’obtenir un inhibiteur de point de contrôle que ceux couverts par Medicaid. Pour la thérapie CAR-T, l’écart est encore plus grand : les patients noirs ont 31 % moins de chances d’y avoir accès que les patients blancs. Pourquoi ? Parce que la thérapie CAR-T ne peut être administrée que dans des centres spécialisés - seulement 15 % des centres de cancer aux États-Unis en sont capables, mais ils en administrent 87 %. Il faut des équipes formées à la gestion des toxicités, des laboratoires de fabrication, et des infrastructures coûteuses. En Europe, le premier traitement CAR-T a été approuvé en août 2018, près de 10 mois après les États-Unis. Le coût, la complexité, et la logistique créent un système où les patients les plus vulnérables sont souvent les derniers à bénéficier des avancées.Le futur : des traitements plus intelligents, plus accessibles
Les prochaines étapes vont dans deux directions. D’abord, rendre la thérapie CAR-T « prête à l’emploi ». Des chercheurs développent des CAR-T « allogéniques » - fabriquées à partir de donneurs sains, stockées en laboratoire, et administrées comme un médicament classique. Cela réduirait les délais de traitement de plusieurs semaines à quelques jours. Ensuite, cibler de nouveaux freins immunitaires. Outre PD-1 et CTLA-4, des protéines comme LAG-3 et TIM-3 sont maintenant étudiées comme cibles. Une autre piste : bloquer la protéine PTP1B à l’intérieur des cellules T - une découverte récente qui a augmenté de 2,3 fois l’infiltration des lymphocytes dans les tumeurs de sein chez la souris. L’avenir de l’immunothérapie n’est pas dans un seul traitement, mais dans des combinaisons intelligentes, personnalisées, et mieux tolérées. Ce n’est plus juste une question de détruire le cancer. C’est de réapprendre à faire travailler le corps contre lui.
Les effets secondaires à connaître
- Les inhibiteurs de points de contrôle : fatigue (35-50 % des patients), éruption cutanée (30-40 %), colite (10-15 %), hypothyroïdie (5-10 %).
- La thérapie CAR-T : fièvre et SLC (50-70 %), troubles neurologiques (20-40 %), baisse des globules blancs, infections sévères.
Les deux peuvent causer des maux de tête et de la fatigue. Mais les effets de la CAR-T apparaissent souvent en quelques jours après la perfusion, tandis que ceux des inhibiteurs peuvent se manifester des semaines ou des mois plus tard.
Que faire si vous êtes candidat à l’immunothérapie ?
- Discutez avec votre oncologue de votre type de cancer, ses mutations, et votre historique immunologique.
- Si vous avez un cancer du sang récidivant, la CAR-T pourrait être une option. Pour un cancer du poumon ou du mélanome avancé, un inhibiteur de point de contrôle est souvent le premier choix.
- Demandez si vous pouvez participer à un essai clinique combinant les deux approches.
- Évaluez les centres de traitement : la CAR-T nécessite une infrastructure spécialisée. Ne vous contentez pas du premier centre disponible.
Quelle est la différence entre les inhibiteurs de points de contrôle et la thérapie CAR-T ?
Les inhibiteurs de points de contrôle sont des médicaments injectables qui débloquent le système immunitaire en bloquant des protéines qui empêchent les lymphocytes T d’attaquer le cancer. La thérapie CAR-T, elle, consiste à prélever les propres cellules T du patient, à les modifier génétiquement pour qu’elles reconnaissent le cancer, puis à les réinjecter. Le premier est un médicament « tout prêt », le second est un traitement sur mesure.
La thérapie CAR-T fonctionne-t-elle sur tous les types de cancer ?
Non. Elle est très efficace pour certains cancers du sang comme la leucémie lymphoblastique aiguë et certains lymphomes, avec des taux de rémission de 60 à 90 %. Mais pour les tumeurs solides - comme le poumon, le sein ou le pancréas - les résultats restent faibles, avec moins de 10 % de réponses objectives dans la plupart des essais. Des recherches en cours visent à améliorer son efficacité sur ces cancers.
Pourquoi la thérapie CAR-T est-elle si chère ?
Parce qu’elle est personnalisée. Chaque dose est fabriquée à partir des cellules d’un seul patient, ce qui demande un processus complexe : prélèvement, modification génétique, culture en laboratoire, tests de qualité, et réinfusion. Le coût total est entre 373 000 et 475 000 $, couvrant la logistique, la technologie et les soins spécialisés nécessaires.
Les inhibiteurs de points de contrôle peuvent-ils provoquer des effets secondaires à long terme ?
Oui. Certains patients développent des troubles auto-immunes durables, comme une hypothyroïdie permanente, un diabète de type 1, ou une inflammation des glandes salivaires. Ces effets peuvent apparaître des mois ou des années après le traitement. Un suivi à long terme est donc essentiel.
Est-ce que la combinaison de CAR-T et d’inhibiteurs de points de contrôle est plus efficace ?
Oui, mais avec des risques. Des études montrent que combiner les deux peut améliorer la réponse chez les patients avec des tumeurs solides. Cependant, les effets secondaires sont plus fréquents et plus graves. Des recherches récentes développent des CAR-T qui produisent elles-mêmes des inhibiteurs localement - ce qui réduit les effets systémiques tout en augmentant l’efficacité.
Prochaines étapes pour les patients
Si vous ou un proche êtes concerné, parlez à votre oncologue de l’immunothérapie. Posez des questions précises : Quel est le type de cancer ? Quelles sont les mutations connues ? Y a-t-il un essai clinique disponible ? Est-ce que mon centre a l’expérience nécessaire ?
Les traitements ne sont pas parfaits. Mais ils offrent une nouvelle possibilité - une chance de vivre longtemps avec un cancer qui, il y a dix ans, était une phrase finale. L’immunothérapie ne guérit pas tout. Mais elle a redonné l’espoir à des milliers de personnes. Et ce n’est que le début.


7 Commentaires
Ça coûte une fortune, c’est compliqué, et ça marche à peine pour 20 % des gens. On se demande vraiment si c’est de la médecine ou de la spéculation pharmaceutique.
/p>La thérapie CAR-T, bien que révolutionnaire sur le plan technologique, soulève des questions éthiques fondamentales concernant la personnalisation extrême des traitements. La logistique de fabrication, la chaîne du froid, et les normes de qualité exigent une infrastructure qui n’est pas disponible dans la plupart des systèmes de santé publique. Cela crée une fracture thérapeutique inacceptable.
/p>Vous parlez de « réveiller le système immunitaire » comme si c’était un gamin qui dormait. Mais qu’est-ce qui vous dit que ce n’est pas le cancer qui a appris à manipuler les freins immunitaires pour se faire passer pour une partie du corps ? Peut-être que l’immunité n’est pas en défaut - peut-être que la nature a simplement optimisé la survie du cancer, pas du patient. On joue à des jeux de pouvoir avec des mécanismes qu’on ne comprend pas encore. Et on appelle ça de la science ?
Et puis, pourquoi personne ne parle du fait que les inhibiteurs de points de contrôle transforment certains patients en « zombies auto-immuns » ? Moi, j’ai vu un type avec une colite chronique, une thyroïde en morceaux, et une peau qui brûlait comme du papier. Il a survécu au cancer… mais il n’est plus humain. Est-ce que c’est ça, la victoire ?
La CAR-T ? Une arme biologique sur mesure. Un médicament qui coûte plus qu’une maison. Et pourtant, on parle de « rémission » comme si c’était un résultat définitif. Mais les rémissions, dans les cancers solides, durent parfois 6 mois. Ensuite, les cellules cancéreuses apprennent à fuir, à muter, à devenir invisibles. Et on revient au point de départ. Avec un compte bancaire vide.
On vante l’avenir avec les CAR-T allogéniques, mais personne ne parle du rejet. Des cellules étrangères dans le corps, avec des récepteurs chimériques ? C’est comme mettre un robot dans un corps humain et espérer qu’il ne se révolte pas. Et si la réponse immunitaire contre la CAR-T est plus violente que celle contre le cancer ?
On parle de combinaisons. De « blocage de LAG-3 », de « PTP1B », de « cytokines ». Mais ces protéines sont des régulateurs fondamentaux de la tolérance immunitaire. En les bloquant, on ne soigne pas le cancer - on détruit la frontière entre soi et l’étranger. On se transforme en maladie auto-immune ambulante.
Et puis, la question que personne ne pose : pourquoi les patients noirs ont-ils 31 % moins de chances d’accéder à la CAR-T ? Parce que les centres sont dans les quartiers riches ? Ou parce que les algorithmes de sélection privilégient les profils génétiques blancs ? Les données ne le disent pas. Mais je vous le dis : la médecine du futur est raciste, et elle est programmée.
On croit qu’on réinvente la médecine. En réalité, on la finance. Et les patients ? Ils sont les cobayes d’un capitalisme immunologique.
/p>Je trouve ça fou qu’on appelle ça une révolution… alors qu’on continue de laisser les gens mourir parce qu’ils n’ont pas la bonne carte bancaire. C’est pas de la médecine, c’est un spectacle de luxe.
/p>La vraie question n’est pas comment guérir le cancer, mais pourquoi on le traite comme un ennemi à détruire. Peut-être que le corps n’est pas en guerre - peut-être qu’il tente de survivre à lui-même. Et qu’en voulant le forcer à combattre, on le détruit un peu plus.
/p>Je suis médecin dans un centre hospitalier en province, et je peux vous dire : les patients qui arrivent avec un inhibiteur de point de contrôle en main, c’est souvent les seuls qui ont les moyens de se renseigner. Les autres, ils attendent… et le cancer avance. Ce n’est pas une question de science, c’est une question de classe.
/p>En France, on a mis 10 mois de plus que les États-Unis pour approuver la CAR-T… et on se plaint de la lenteur du système de santé ? C’est pas un problème de budget, c’est un problème de culture. Ici, on attend que tout soit parfait avant d’agir. Aux États-Unis, ils testent, ils cassent, ils réparent. Et parfois, ça sauve des vies. On a perdu l’audace.
/p>